Jak to się pali, jak to gasić?
14 Czerwca 2023W 1985 r. japoński chemik Akira Yoshino zaproponował pierwszą baterię litowo-jonową (LiB). W swojej pracy bazował na dotychczasowych osiągnięciach brytyjsko-amerykańskiego chemika Michaela S. Whittinghama i pracach amerykańskiego fizyka, laureata nagrody Nobla za 2019 r. w dziedzinie chemii Johna B. Goodenougha, z lat 70. i 80. XX w. Choć jest ona coraz popularniejsza, to wciąż ma wady, które mogą generować problemy, a z ich efektami walczą potem strażacy.
LiB są mniejsze i lżejsze w porównaniu do konwencjonalnych akumulatorów kwasowo-ołowiowych lub niklowo-kadmowych. Lit okazał się też idealnym materiałem do budowy baterii ze względu na dużą łatwość w oddawaniu jednego elektronu i zamianie w jon, przemieszczający się pomiędzy elektrodami. Te zalety zachęciły do masowego zastępowania konwencjonalnych technologii akumulatorowych nowymi, litowo-jonowymi. Przewiduje się, że wielkość globalnego rynku baterii litowo-jonowych wzrośnie pięciokrotnie - z 58,6 mld USD w 2021 r. do 278,3 mld USD w 2030 r. [1].
Rozwiązania te mają jednak pewną wadę. Jeśli temperatura wewnętrzna LiB wykracza poza zakres roboczy, elementy wewnętrzne baterii stają się niestabilne i mają tendencję do generowania dodatkowego ciepła. Jeśli to ciepło nie zostanie rozproszone, temperatura akumulatora będzie dalej rosła, przyspieszając proces wydzielania ciepła, prowadząc do tzw. ucieczki termicznej (ang. thermal runaway). Skład chemiczny LiB różni się od tradycyjnych akumulatorów ołowiowych. Wykorzystuje się w nich łatwopalny elektrolit organiczny, który stwarza ryzyko pożaru w przypadku wystąpienia niekontrolowanego wzrostu temperatury lub uszkodzenia mechanicznego jej wewnętrznego separatora. Zjawisko to pozostaje w ostatnich latach przedmiotem licznych badań, nie przyniosły one jednak dotychczas w pełni zadowalających wyników.
Kolejnym problemem jest gaszenie pożaru tych baterii. Chociaż teoretycznie można je ugasić wieloma metodami, w praktyce okazuje się, że skutki ucieczki termicznej są trudniejsze do opanowania niż w przypadku innych pożarów, a ponadto wymagane jest długotrwałe chłodzenie, zapobiegające ponownemu samozapłonowi.
Budowa ogniwa litowo-jonowego
Ogniwo litowo-jonowe składa się z katody, anody, separatora i elektrolitu. Materiały anody i katody są osadzane odpowiednio na kolektorach prądu, wykonanych z folii miedzianej i aluminiowej. Elektrolit, będący roztworem soli litu w rozpuszczalnikach organicznych, umożliwia ruch jonów litu między elektrodami, podczas gdy separator zapobiega zwarciu między dwiema elektrodami, ale jednocześnie umożliwia transfer jonów. Podczas reakcji rozładowania baterii jony litu przemieszczają się z anody i wprowadzają do pustych przestrzeni między warstwami kryształów katody (proces zwany interkalacją), a przy jej ładowaniu proces przebiega odwrotnie. Schemat budowy LiB i zachodzące w niej procesy przedstawia rys. 1. Podczas początkowego ładowania interkalowane jony litu reagują natychmiast z rozpuszczalnikiem elektrolitu i tworzą na anodzie warstwę stałego elektrolitu (pasywacyjną), stanowiącą strefę międzyfazową (SEI), która jest przepuszczalna dla jonów litu, ale nie do elektrolitu. Stabilność SEI decyduje o bezpieczeństwie i żywotności LiB. Wydajność, koszt i bezpieczeństwo LiB zależą od ich budowy i składu elektrochemicznego. 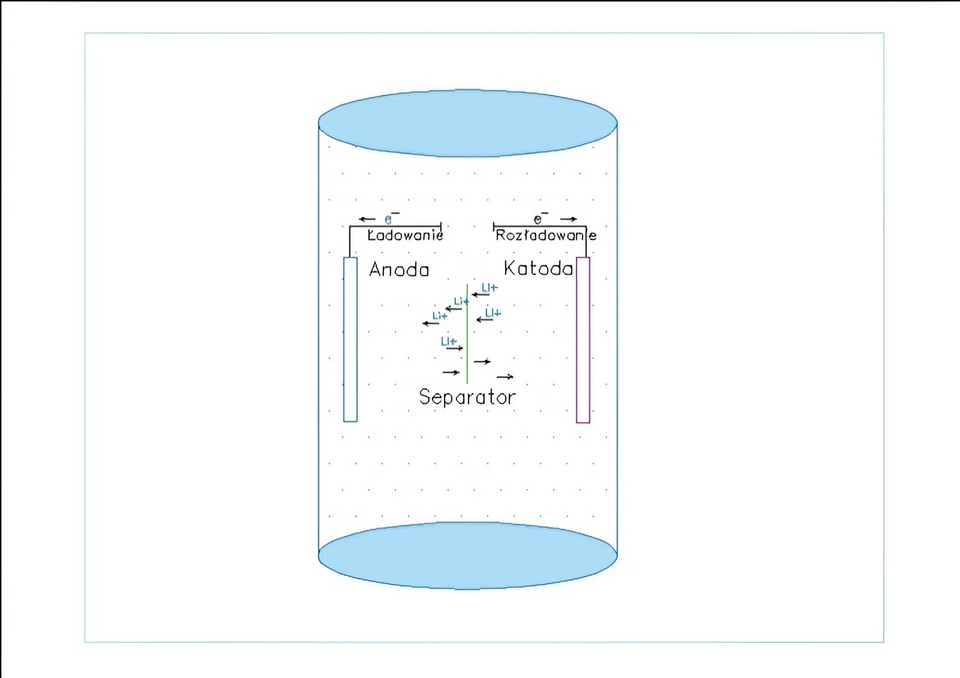 Na przykład ogniwo litowo-jonowe z dodatnią elektrodą LCO i grafitową elektrodą ujemną zapewnia wysokie napięcie i gęstość energii, ale stwarza większe ryzyko niekontrolowanej temperatury, co może prowadzić do pęknięcia ogniwa, odpowietrzenia, zapłonu elektrolitu i pożaru.
Na przykład ogniwo litowo-jonowe z dodatnią elektrodą LCO i grafitową elektrodą ujemną zapewnia wysokie napięcie i gęstość energii, ale stwarza większe ryzyko niekontrolowanej temperatury, co może prowadzić do pęknięcia ogniwa, odpowietrzenia, zapłonu elektrolitu i pożaru.
Katoda
Katoda zbudowana jest z tlenków litu i innego metalu, np. tlenek litowo-kobaltowy (LCO), tlenek niklowo-kobaltowo-glinowy (NCA), fosforan litowo-kobaltowy (LCP). Metale używane jako materiały katodowe dobierane są ze względu na ich wysoką zdolność do interkalacji litu oraz zgodne właściwości chemiczne i fizyczne (np. odwracalność reakcji interkalacji) niezbędne do transportu jonów litu. Dotychczas materiały katodowe o dużej pojemności i napięciu, takie jak nikiel, mangan i materiały bogate w lit, powlekane węglem nanosfery LFP i pięciotlenkiem wanadu, zostały uznane za najlepsze.
Anoda
Najpopularniejszym materiałem stosowanym do produkcji anody jest grafit. Wynika to z jego wysokiego potencjału ujemnego. Inne materiały, takie jak tytanian litu i silikon, działają przy niższych napięciach ujemnych, zmniejszając energię i gęstość mocy, co czyni je w większości przypadków mniej praktycznymi. Wyjątek stanowią tu urządzenia do szybkiego ładowania i stałe moduły magazynów energii, gdzie znaczenie gęstości energii jest mniejsze.
Separator
Katoda i anoda są oddzielone od siebie porowatą membraną zwaną separatorem. Separator jest kluczowym elementem ogniwa litowo-jonowego. Nie tylko zapobiega zwarciom elektrycznym między dwiema elektrodami, ale też umożliwia transport jonów litu między elektrodami. Najpopularniejszymi materiałami separacyjnymi dla LiB z elektrolitami organicznymi są mikroporowate folie poliolefinowe, takie jak polietylen (PE) i polipropylen (PP), które zapewniają jednocześnie wysoką stabilność chemiczną, dobre właściwości mechaniczne i niski koszt.
Elektrolit
Elektrolit wypełnia przestrzeń między separatorem a elektrodami. Formuła elektrolitu w LiB zależy od materiałów elektrod i warunków pracy. Typowy elektrolit dla LiB składa się z łatwopalnego rozpuszczalnika organicznego na bazie węglanów, takiego jak węglan etylenu (EC), z dodatkami zwiększającymi żywotność, takimi jak np. heksafluorofosforan litu (LiPF6).
Akumulatory litowo-jonowe
Na rynku dostępne są ogniwa litowo-jonowe w kształcie guzika, cylindrycznym, saszetkowym i pryzmatycznym. Na fot. 1. widoczne jest ogniwo w kształcie cylindrycznym.
Ogniwa łączy się w moduły równolegle, aby zwielokrotnić ich pojemność, lub szeregowo, aby zsumować napięcie (fot. 2).
 |
 |
Ucieczka termiczna i pożar
Mimo powszechnego stosowania LiB do magazynowania energii są one podatne na niekontrolowany wzrost temperatury i pożar. Tak zwana ucieczka termiczna występuje, gdy pęka separator, co powoduje agresywną reakcję egzotermiczną wynikającą ze zgazowania elektrolitu. Może to skutkować poważnymi pożarami, wybuchami i propagacją między ogniwami litowo-jonowymi. Do ucieczki termicznej i pożaru w LiB prowadzą najczęściej:
- przeładowanie lub rozładowanie do napięć przekraczających wartości określone przez producenta,
- wysoka temperatura wewnętrzna 90-120°C powoduje egzotermiczny rozkład warstwy SEI w LiB, przy 200°C elektrolit węglowodorowy może ulec rozkładowi i wydzielać dodatkowe ciepło),
- uszkodzenia mechaniczne, zwykle spowodowane zewnętrznymi zdarzeniami losowymi, takimi jak wypadek samochodowy lub podczas instalacji (mogą spowodować zwarcie elektryczne między elektrodami, powodujące miejscowe nagrzewanie, skutkujące samozapłonem - obrazuje to sekwencja fot. 3-5).
 |
 |
 |
Opisane powyżej zdarzenia awaryjne prowadzą do wewnętrznego zwarcia związanego z przerwaniem ciągłości separatora i kontaktem między katodą i anodą przez elektrolit. Uwalniane wówczas ciepło zwiększa temperaturę ogniwa i inicjuje kolejne reakcje egzotermiczne, tworząc tzw. pętlę reakcji ciepło-temperatura. Prowadzi to także do wzrostu ciśnienia, pęcznienia i pękania komórek, uwalniania gazów (czasem gwałtownych) i powstania pożaru.
Techniki ochrony przeciwpożarowej
Pożar LiB jest pożarem szczególnym ze względu na różnorodność materiałów palnych wchodzących w skład baterii. Należą do nich: materiał separatora, materiał konstrukcyjny (klasa A), elektrody (klasa D), ciekły elektrolit (klasa B) oraz aparatura elektryczna pod napięciem (klasa E). Metoda gaszenia takiego pożaru powinna uwzględniać możliwość gaszenia wszystkich wymienionych typów pożarów i jednocześnie ograniczać wzrost temperatury, tak aby nie dochodziło do ucieczki termicznej w kolejnych modułach baterii. Badania pokazują, że ważniejsze jest skuteczne chłodzenie ogniw w dużym pakiecie akumulatorów, aby zapobiec rozprzestrzenianiu się ciepła, niż gaszenie palącego się pojedynczego ogniwa.
Odpowiednie środki ochrony przeciwpożarowej LiB są stosowane na poziomie ogniwa, akumulatora, modułu, pakietu, systemu i obudowy. Powinny one uwzględniać zarówno zagrożenia powstające wewnątrz baterii, jak i pochodzące z otoczenia. Zabezpieczenia zintegrowane z bateriami nie zawsze jednak są wystarczające. W przypadku zapalenia się modułu baterii należy zatem stosować zewnętrzne systemy gaśnicze. Najczęściej zalecanymi przez producentów środkami gaśniczymi są woda i środki chemiczne, a zaraz za nimi CO2 i środki pianowe. Poniżej omówione zostaną podstawowe wady i zalety wybranych środków.
Woda jest doskonałym środkiem chłodzącym ze względu na dużą pojemność cieplną i utajone ciepło parowania i może być w stanie złagodzić lub zatrzymać rozprzestrzenianie się ciepła na otaczające akumulatory. Należy jednak zauważyć, że woda może reagować z LiPF6, tworząc toksyczny i szkodliwy fluorowodór (HF), który może być chemicznie redukowany przez lit i wytwarzać palny wodór, przewodzić prąd i powodować zewnętrzne zwarcia w ogniwie, skutkujące ucieczką termiczną LiB. Wodę można stosować w postaci:
- strumienia kierowanego bezpośrednio na płonące materiały, zapewniając chłodzenie i zapobiegając ponownemu zapłonowi (strumienia wody nie należy stosować na urządzeniach elektrycznych pod napięciem ze względu na ryzyko porażenia prądem),
- zraszaczy lub tryskaczy wytwarzających małe krople wody lub generujących mgłę wodną (krople < 1000 µm). Drobniejsze kropelki mają większy stosunek powierzchni do objętości w porównaniu z większymi kropelkami, co skutkuje większą absorpcją energii cieplnej z gorącego powietrza dla tej samej objętości wody, jednak większe krople dają większą pewność dotarcia do źródła ognia przed odparowaniem. Dodanie do wody środków powierzchniowo czynnych zmniejsza napięcie powierzchniowe wody, dzięki czemu pokrywa ona płonące materiały i skuteczniej je chłodzi.
Systemy pianowe ochładzają i uszczelniają powierzchnię źródła pożaru, ograniczając dostęp powietrza. Aby piana była skuteczna, musi całkowicie w pełni przykryć źródło pożaru, co jest trudne w przypadku LiB, charakteryzujących się spalaniem wielostopniowym z uwalnianiem łatwopalnego gazu odrzucającego nagromadzoną pianę.
Proszkowe środki gaśnicze działają chemicznie, przerywając reakcje pożaru. Nie zapewniają one jednak chłodzenia i nie zapobiegają ponownym zapłonom. Proszki mogą powodować problemy z oddychaniem, zwłaszcza wewnątrz pomieszczeń.
Dwutlenek węgla ma działanie gaśnicze dzięki efektowi zastępowania tlenu w strefie spalania. Może być używany do gaszenia pożarów klasy A i B, i jest bezpieczny w przypadku pożarów urządzeń elektrycznych (klasa E). Badania pokazały jednak, że CO2 nie jest środkiem gaśniczym odpowiednim do pożarów LiB ze względu na małą zdolność chłodzenia.
Podsumowanie
Baterie litowo-jonowe budzą zainteresowanie ze względu na ich zdolność do przetwarzania wysokich napięć, lekkość, niewielkie skłonności do samorozładowywania i długą żywotność. Należy mieć jednak świadomość, że wszelkie uszkodzenia (termiczne, elektryczne i mechaniczne), mogą wpływać na wydajność baterii i powodować problemy związane z bezpieczeństwem, takie jak niekontrolowany wzrost temperatury, uwalnianie się elektrolitu, pożar, a nawet wybuch.
Z tego względu od wielu lat trwają badania nad zabezpieczeniami LiB na różnych poziomach, począwszy od etapu projektowania składu chemicznego ich elementów, zabezpieczeń przeciwpożarowych wewnętrznych po zewnętrzne systemy gaszenia pożarów. Systemy zarządzania bateriami (BMS), które utrzymują bezpieczne środowisko pracy modułów i pakietów, są stale ulepszane, jednak pożary LiB nadal się zdarzają, a skutki ucieczki termicznej są trudne do opanowania i wymagają długotrwałego chłodzenia. Dodatkowym problemem jest fakt, że zespoły LiB znajdują się zwykle w ciasnych obudowach z minimalną wolną przestrzenią, co utrudnia dostęp środków gaśniczych.
Woda pod różnymi postaciami wydaje się być jednym z najlepszych środków do gaszenia pożarów LiB, chociaż trwające badania potwierdzają również dużą skuteczność środków chemicznych, które są w stanie przerwać łańcuch reakcji chemicznych powstający przy pożarze LiB. W najbliższym czasie planowane są badania Politechniki Łódzkiej nad skutecznością działania mgły wodnej i środków chemicznych w zestawach magazynów energii, które stają się coraz powszechniejsze zarówno w zakładach przemysłowych, jak i w prywatnych domach. Mamy nadzieję, że dadzą one szansę potwierdzenia skuteczności gaśniczej nowych, zoptymalizowanych kosztowo systemów dostosowanych do tego typu układów bateryjnych.
Przypisy:
[1] https://www.precedenceresearch.com/lithium-ion-battery-market.
Literatura dostępna u autorek
dr hab. inż. Dorota Brzezińska jest profesorem Politechniki Łódzkiej na Wydziale Inżynierii Procesowej i Ochrony Środowiska, zajmuje się dydaktyką z zakresu inżynierii poż., systemów wentylacji poż. oraz strategii ochrony ppoż w budownictwie

Natalia Kraus-Namroży jest doktorantką Politechniki Łódzkiej na Wydziale Inżynierii Procesowej i Ochrony Środowiska, pracuje jako projektant instalacji ppoż. oraz inżynier budowy
